Teorie
Elektrochemické (galvanické) články
Existuje celá řada fyzikálních principů, které umožňují transformovat jiné formy energie na energii elektrickou. Nejširší uplatnění mezi těmito „náhradními zdroji“ mají zdroje elektrochemické, které buď nevratným způsobem (tzv. primární články) nebo vratným způsobem (sekundární články, též akumulátory), umožňují transformovat chemickou energii některých chemických reakcí na energii elektrickou.
Výhodou elektrické energie je možnost jednoduchých přenosů na i na velké vzdálenosti a poměrně lehký převod na jiné druhy energie. Ovšem jsou zde i nevýhody. Tou hlavní je velmi špatná účinnost uskladňování elektrické energie. A pravě elektrochemické články mají za úkol elektrickou energii uskladňovat s pokud možno největší účinností.
Zinkové primární články:
Primární články se Zn anodou patří stále k nejrozšířenějším elektrochemickým zdrojům proudu. Jejich jmenovité napětí je 1,5 V. Do této skupiny můžeme zařadit následující běžně vyráběné elektrochemické systémy:
MnO2/Zn s mírně kyselým elektrolytem s převahou NH4Cl (Leclanchéův článek)
MnO2/Zn s mírně kyselým elektrolytem s převahou ZnCl2 (Zinko-chloridový článek)
MnO2/Zn s alkalickým elektrolytem (Alkalický článek)
Baterie systému oxid manganičitý zinek s mírně kyselým elektrolytem jsou často nazývané jako baterie zinkouhlíkové, přestože uhlík v nich neslouží jako elektrochemicky aktivní materiál, ale jen jako proudový kolektor. Někdy jsou tyto baterie též označovány jako zinko-burelové články, což by bylo asi správnější. A aby toho pojmenovávání nebylo málo, jsou tyto články též známé, pod označením jako suché články, protože elektrolyt je zde znehybněn (není v kapalném stavu).
1. Leclanchéův článek
Leclanchérův článek je elektrochemickým zdrojem systému: oxid manganičitý zinek (MnO2–Zn) s mírně kyselým elektrolytem s převahou NH4Cl (salmiak). Jedná se o první masově vyráběný druh chemického zdroje elektrické energie. V Leclancheově článku se používá zinek jako anoda, oxid manganičitý je použit jako katoda a chlorid amonný se používá jako hlavní část elektrolytu, ale je v elektrolytu i nějaký podíl chloridu zinečnatého. Zinek se oxiduje a každý atom zinku zapojený v této reakci uvolňuje dva elektrony. Tyto elektrony odcházejí do vnějšího obvodu. Na katodě je MnO2 redukován za vzniku vodu a amoniaku. Ale při této chemické reakci některé z amonných iontů se přímo redukuje elektrony a vytvářejí plynný amoniak a vodík.
Záporná elektroda:
Kladná elektroda:
Tento plynný amoniak dále reaguje s chloridem zinečnatým (ZnCl2) a dojde k vytvoření pevného chloridu diamminzinečnatého a plynný vodík reaguje s oxidem manganičitým za vzniku pevného oxidu manganitého a vody.
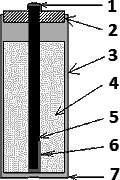
1 – kovová čepička (+)
2 – izolační zátka
3 – zinkový plášť
4 – elektrolyt
5 – uhlíková elektroda
6 – depolarizátor
7 – kovové dno (–)
Následné pohlcování vzniklých plynů lze zapsat následujícími reakcemi (Těmito reakcemi se zabrání tvorbě tlaku při vybíjení baterie):
Celkovou reakci lze tedy zapsat:
Zn + 2 MnO2 + 2 NH4Cl → Mn2O3 + [Zn(NH3)2] Cl2 + H2O
Nevýhodou tohoto článku a jeho uspořádání je to, že kovová zinková anoda (současně tvořící nádobu článku) se během vybíjení nerovnoměrně rozpouští a tak může docházet k předčasnému vytékání elektrolytu, který mohl zničit spotřebič. K zamezení tohoto jevu, býval do článku přidáván vysoce toxický chlorid rtuťnatý. Tento postup je dnes sice zakázán, bohužel se s ním můžeme ještě setkat u některých východoasijských baterií.
Z výše uvedeného důvodu jsou dnes většinou výrobců Leclancheovy články nahrazovány bateriemi systému oxid manganičitý zinek s mírně kyselým elektrolytem s převahou chloridu zinečnatého, označovanými jako zinko-chloridové články.
2. Zinko-chloridový článek
Zinko-chloridový článek je opět elektrochemickým zdrojem systému: oxid manganičitý zinek (MnO2–Zn) s mírně kyselým elektrolytem, ale tentokráte s převahou ZnCl2 (chlorid zinečnatý). Její konstrukční uspořádání je shodné s Leclanchéovým článkem. Zinek se používá jako anoda, oxid manganičitý se používá jako katoda a chloridu zinečnatý se používá jako elektrolyt.
Elektrochemický děj probíhající při vybíjení se de facto liší jen reakcí na kladné elektrodě:
Záporná elektroda:
Kladná elektroda:
I u tohoto galvanického článku následují další reakce:
Celkovou rovnice článku je možné vyjádřit následující rovnicí:
4 Zn + 8 MnO2 + ZnCl2 + 9 H2O → 8 MnO(OH) + ZnCl2 · 4 ZnO · 5 H2O
Z porovnání rovnic (1) a (2) vidíme, že při vybíjení baterií s chloridem amonným voda vzniká, při vybíjení zinko-chloridových baterií se naopak voda spotřebovává. Proto jsou zinko-chloridové baterie mnohem méně náchylné na vytékání elektrolytu. Další výhodou těchto článků je docílení výrazného prodloužení povolené doby skladování takových baterií (až 3 roky). Technické parametry zinko-chloridových článků závisí zejména na typu použitého oxid manganičitého. Náhradou přírodního oxidu za elektrolyticky připravený lze výrazně zvýšit užitné vlastnosti článků, ale bohužel za cenu vyšší ceny.
3. Alkalický článek
Alkalické články jsou články systému oxid manganičitý zinek (MnO2–Zn) s alkalickým elektrolytem. Oproti bateriím s chloridovým elektrolytem jsou alkalické baterie schopné poskytovat mnohem větší proudy při malém poklesu napětí, proto jsou vhodné pro aplikace, kde je vyžadována velká proudová zátěž (hračky, digitální fotoaparáty…). Samozřejmě jsou používány i v zařízeních s malými proudovými odběry, a to hlavně tam, kde je kladen důraz na ochranu zařízení před únikem elektrolytu. Ocelová nádobka článku je kladným pólem, neslouží jako elektrochemicky aktivní materiál a nezúčastňuje se tedy elektrochemické reakce, což prakticky zamezuje možnosti vytékání elektrolytu způsobenému její korozí.
V alkalickém článku slouží práškový zinek jako záporná elektroda, oxid manganičitý slouží jako kladná elektroda a hydroxid draselný slouží jako elektrolyt:
Záporná elektroda:
Kladná elektroda:
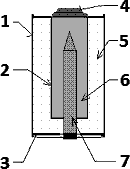
1 – kovové pouzdro
2 – separátor
3 – plastový uzávěr
4 – kovová čepička (+)
5 – MnO2 a práškový uhlík
6 – zinek a elektrolyt (gel)
7 – sběrná elektroda (–)
2 MnO2 + Zn → Mn2O3 + ZnO
Někdy je v celkové reakce ještě zohledněna následná reakce vznikajícího ZnO s elektrolytem KOH, která již však nemá vliv na vznikající elektrické napětí (nemění se oxidační čísla):
Alkalický článek je dimenzován na 1,5 V. Nový nevybitý alkalický článek ukazuje napětí 1,50-1,65 V. Průměrná hodnota napětí za stavu zatížení může být 1,1-1,3 V. Kupříkladu klasický tužkový alkalický článek (typ AA) je obecně dimenzován pro jmenovitý proud až 700 mA.
Z porovnání rovnic (1), (2) a (3) vyplývá, že předností alkalických článků je vyšší využití MnO2, neboť redukce Mn4+ u nich probíhá až na Mn2+, zatímco u baterií s mírně kyselým elektrolytem se proces zastaví na Mn3+.
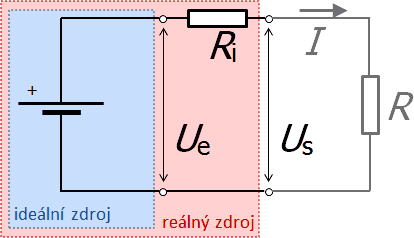
Elektromotorické napětí a vnitřní odpor zdroje
Na základě chování reálného zdroje si jej představujeme jako soustavu složenou ze zdroje ideálního spojeného s určitým odporem, který je uvnitř zdroje. Každý zdroj je tak charakterizován tzv. elektromotorickým napětím Ue (napětí ideálního zdroje) a vnitřním odporem Ri (odpor zapojený do série k ideálnímu zdroji). Vnitřní odpor ovlivňuje chování zdrojů v obvodech a způsobí, že při zapojení zdroje do obvodu není napětí na svorkách zdroje (svorkové napětí) Us rovno elektromotorickému napětí. Podle Ohmova zákona je svorkové napětí oproti napětí elektromotorickému nižší o velikost součinu Ri·I, kde I je proud v obvodu.
Zapojíme-li tedy zdroj do obvodu s rezistorem o odporu R, prochází obvodem proud I, jehož velikost je dána Ohmovým zákonem pro uzavřený obvod:
Pro svorkové napětí Us pak platí vztah:
Ze vztahu (5) plyne, že pokud zdroj do obvodu nedodává žádný proud (I = 0), je svorkové napětí rovno elektromotorickému napětí (Us = Ue). Naopak pro Us = 0 (tj. pro R = 0 – zkratování zdroje) protéká obvodem maximální tzv. zkratový proud Ik, který je omezen pouze vnitřním odporem (plyne ze vztahu (4)):
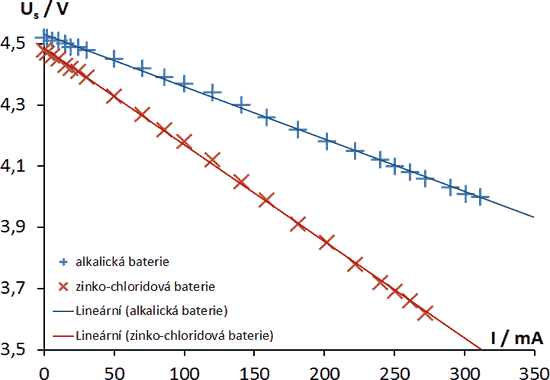
Na obrázku výše je uvedena závislost svorkového napětí Us = Us(I ) na proudu procházejícímu obvodem pro dva různé typy zdrojů (alkalický a zinko-chloridový). Dle vztahu (5) se jedná o přímky s různou směrnicí (sklonem), která je dána vnitřním odporem Ri (dáno konstrukcí zdroje). V obou případech se jedná o tzv. lineární zdroje.
Ze závislostí je možné přímo odečíst základní parametry zdroje:
Ue – hodnotu elektromotorického napětí jako hodnotu svorkového napětí při I = 0;
Ik – zkratový proud jako hodnotu proudu při zkratování zdroje (tj. když Us = 0 V, viz vztah (6) );
Ri – vnitřní odpor zdroje jako hodnotu směrnice závislosti
(
).
Série naměřených hodnot daných závislostí můžeme velmi dobře proložit lineární regresí. Jedlotlivé regresní koeficienty pak odpovídají parametrům zdroje Ue a Ri – viz vztah (5). Pro rychlé získání rovnice regresní přímky lze využít tabulkového kalkulátoru (MS Excel, OO Calc, Google Tabs apod.). Zktatový proud lze nejen získat pomocí vztahu (6), ale i metodou tzv. extrapolace. Tato metoda spočívá v tom, že pomocí prodloužení regresní přímky najdeme průsečík závislosti Us = Us(I ) s vodorovnou osou – tedy hodnotu I, pro kterou platí Us = 0 (což je právě zkratový proud Ik).